プロスタグランジン
(PG) は多彩な生体作用を持ち、発熱や痛覚修飾といった病態下における役割がよく知られています。このことは、アスピリンやインドメタシンの様な非ステロイド性抗炎症薬
(NSAIDs) の抗炎症作用が PG 合成の律速酵素であるシクロオキシゲナーゼ (COX) の阻害を作用機序とすることからも理解できます。その一方で、PG
は排卵や分娩をはじめとする雌性の生殖生理過程を媒介する重要な因子であることも古くから指摘されています。中でも、(1) 分娩時の子宮では PGF2
alpha や PGE2 が大量に産生されること、(2) NSAIDs が分娩遅延の副作用を持つこと等から、PG が生体内で分娩誘導に何らかの重要な役割を持っていると考えられていました。しかし、生体内で分娩時においてどの種類の
PG がどのような役割を持つことで分娩誘導に貢献するのかについてはほとんど不明でした。
そこで 私達は、まずPG の中でも卵巣黄体の退縮や子宮収縮といった生殖系に主な作用が推定されている PGF2 alpha、及びその FP
受容体のシステムに着目しました。そして、FP 受容体を遺伝的に欠損させて PGF2 alpha が機能できないようなマウス(FP
欠損マウス)を作製しました。すると、この FP
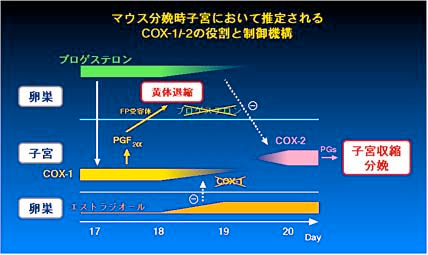
欠損マウスでは妊娠はできるものの、卵巣ホルモンの分泌異常により胎仔を分娩できないことが分かりました。通常、マウス等多くの動物種においては、妊娠期
間中には卵巣の黄体が成熟して卵巣ホルモンであるプロゲステロンを大量に産生して妊娠状態が維持され、分娩時には黄体が退縮してプロゲステロンが産生され
なくなり、これが妊娠子宮に分娩開始シグナルとして伝えられます。ところが、この FP
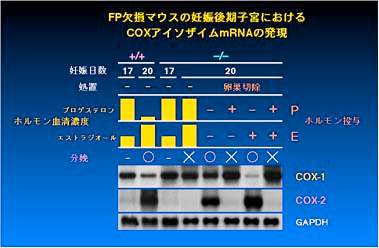
欠損マウスでは分娩の時期になっても黄体が退縮せずにプロゲステロンの産生を続け、その結果、分娩が起こっていないことが明らかになったのです(Fig.
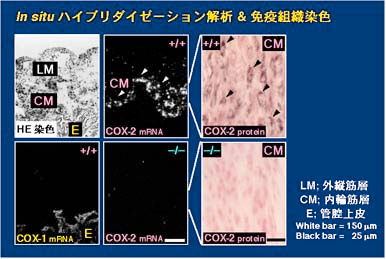
1)。卵巣の黄体には FP 受容体遺伝子が大量に発現しており、外因性に投与した PGF2 alpha には黄体退縮作用があることから、私達は
PGF2 alpha と FP
受容体のシステムが実際に生体内で黄体退縮作用を介してマウスの分娩誘導に必須の役割を果たしていると結論しました(Fig. 2)(文献1)。
なお、FP 欠損マウスの卵巣を分娩予定日前日に切除してプロゲステロンの血清濃度を低下させることで分娩を回復できたことから、子宮のレベルでは
FP 欠損マウスに異常はないと考えられました。
Fig.1